
Gestión
AVANCE CIENTÍFICO
Invima da luz verde a primer estudio de plasma convaleciente a pacientes con CoVID19 en el país
Los estudios clínicos se realizarán en la Clínica de Occidente, el hospital universitario Mayor Méderi y la Corporación para Estudios en Salud Clínica.
Viernes, 29 de mayo de 2020, a las 11:35
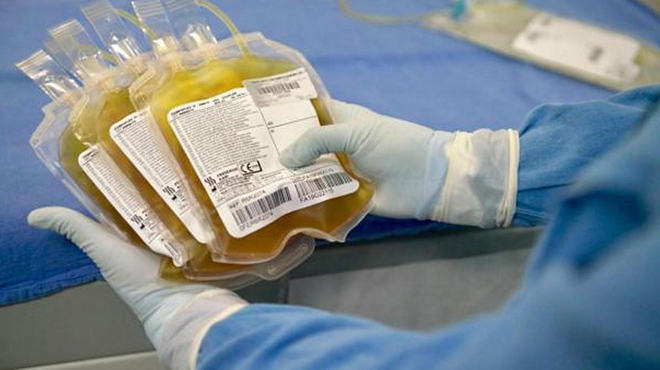
Los estudios iniciales contarán con la participación de 90 pacientes. |
Redacción Bogotá.
Mediante una resolución el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima), ha aproado el primer protocolo de investigación clínica con medicamentos, para la atención de la emergencia por CoVID19 en el país. El estudio que ha aprobado el Instituto es el de Plasma Convaleciente que ha sido adelantado por el Instituto distrital de Ciencia, Biotecnología e Innovación en Salud.
Así mismo la entidad ha señalado que el estudio ‘PC-COVID-19 Plasma de Convalecencia para Pacientes con la CoVID19’, contará con un período de prueba de nueve meses y seguirá siendo patrocinado por la Universidad del Rosario mediante la especialidad de Medicina Interna Fase II.
Revise aquí la resolución
El centro regulador también ha aclarado que dichos estudios serán llevados a cabo en la Clínica de Occidente, el Hospital Universitario Mayor Méderi y la Corporación para Estudios en Salud Clínica (CES), siendo estos dos últimos los responsables de que dicho estudio se lleve a cabo bajo unas buenas prácticas saludables.
Lea también Investigadores colombianos estudian tratamiento con plasma convaleciente en pacientes con CoVID19
Dentro de las consideraciones para dar el aval al estudio, el Invima le ha solicitado a la Universidad del Rosario, como patrocinador “reportar ante el Invima todos los eventos adversos serios relacionados con fallecimientos, en un plazo no mayor a veinticuatro (24) horas contadas a partir de la fecha en que el patrocinador/CRO (Organización de Investigación por Contrato, por sus siglas en inglés) es notificado de su ocurrencia. El resto de los eventos adversos serios deberán ser reportados ante el Invima por el Patrocinador o la CRO, en un plazo no mayor a siete (7) días hábiles contados a partir de la fecha en que el patrocinador es notificado.”
Cabe resaltar que este primer estudio, contará con la participación de 90 pacientes, quienes deberán firmar un consentimiento informado, dicho documento será diligenciado tanto por quien recibe el plasma como por el donante.
Finalmente, la institución en su documento ha resaltado que “el Invima podrá interrumpir en cualquier momento la realización de una investigación clínica o exigir la introducción de modificaciones en su proyecto, en los siguientes casos: a) Alteración de las condiciones de autorización. b) Incumplimiento de las Buenas Prácticas Clínicas. c) Protección a los seres humanos sujetos de ensayo. d) Defensa de la salud pública.
















