
Salud Pública
COMERCIALIZACIÓN ILEGAL
OMS alerta sobre FENTANILO HLB contaminado en Argentina
No se puede descartar que estos productos estén circulando en otros países
Miércoles, 03 de septiembre de 2025, a las 15:26

Producto objeto de alerta. |
Redacción. Bogotá
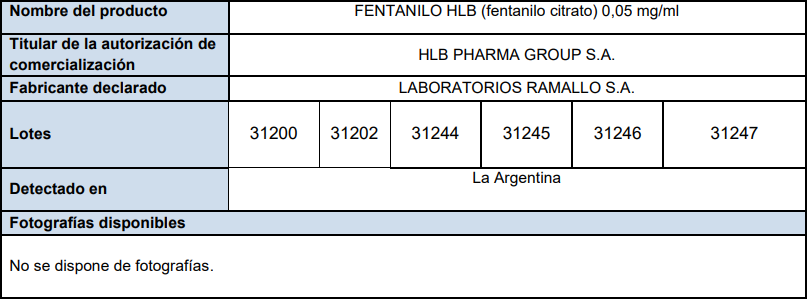
La Organización Mundial de la Salud (OMS) ha emitido una alerta sobre productos médicos que se refiere a seis lotes de FENTANILO HLB (citrato de fentanilo) de calidad subestándar detectados en Argentina.
En mayo de 2025, la OMS constató la existencia de informes relativos a un brote mortal de infecciones bacterianas en la Argentina vinculado a un lote de FENTANILO HLB inyectable (lote 31202) contaminado con cepas de Klebsiella pneumoniae y Ralstonia pickettii resistentes a los antimicrobianos.
Ahora, la información que dispone la OMS indica que varios lotes de FENTANILO HLB están contaminados y, por lo tanto, deben retirarse en la Argentina.
Según el documento, las inyecciones de citrato de fentanilo son analgésicos opioides que se utilizan para aliviar el dolor durante y después de intervenciones quirúrgicas. También se emplean para reducir la frecuencia respiratoria de los pacientes sometidos a ventilación mecánica y para aliviar el dolor intenso de personas con enfermedades crónicas.
Productos objeto de la alerta de la OMS. |
El 13 de mayo de 2025, la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) de Argentina emitió una alerta y ordenó la retirada del mercado del lote 31202 de FENTANILO HLB, que había dado positivo para K. pneumoniae y R. pickettii. Asimismo, indicó que el titular de la autorización de comercialización de FENTANILO HLB en la Argentina era HLB PHARMA GROUP S.A. y que el fabricante era LABORATORIOS RAMALLO S.A., también en Argentina.
El 24 de febrero de 2025, la agencia sanitaria había suspendido la actividad productiva de Laboratorios Ramallo S.A. debido a deficiencias que se clasificaron como críticas y graves en varias áreas, entre ellas incumplimientos que comprometían la seguridad y la eficacia de los productos. El 13 de mayo del mismo año, la ANMAT prohibió el uso, la distribución y la comercialización de todos los productos de HLB PHARMA en el mercado argentino.
Además, emitió otras alertas y disposiciones de retirada de productos de calidad subestándar fabricados o distribuidos por esa firma. No obstante, es posible que continúen en circulación productos de calidad subestándar fabricados por Laboratorios Ramallo S.A.. o por HLB PHARMA.
Por lo tanto y ante las graves deficiencias en las prácticas correctas de fabricación señaladas por la ANMAT, la OMS ha reiterado que es necesario actuar con cautela ante todo producto inyectable o parenteral fabricado o distribuido por Laboratorios Ramallo S.A.. o por HLB PHARMA después de febrero de 2022, ya que podrían estar contaminados y su uso podría comprometer la seguridad de los pacientes.
Ha recomendado extremar la precaución, ya que no se puede descartar que estos productos estén circulando en otros mercados.
Los productos a los que hace referencia la presente alerta se consideran de calidad subestándar, ya que no cumplen las normas de calidad ni los requisitos establecidos. Para proteger a los pacientes, es fundamental detectar y retirar de la circulación estos productos.
Riesgos
FENTANILO HLB (citrato de fentanilo) se administra por inyección. Podría inyectarse a pacientes en estado crítico o sometidos a intervenciones quirúrgicas, quienes son especialmente vulnerables. Por este motivo, la esterilidad y la calidad de los productos resultan fundamentales para su seguridad.
Se considera que la esterilidad de los productos FENTANILO HLB mencionados en la presente alerta de la OMS sobre productos médicos está comprometida, ya que pueden estar contaminados con K. pneumoniae y R. pickettii.
Estos productos contaminados entrañan riesgos importantes para los pacientes y pueden causar infecciones graves y potencialmente mortales, en particular a las personas vulnerables.
Frente a este panorama, se ha pedido a los profesionales de la salud notificar al organismo nacional de reglamentación o al centro nacional de farmacovigilancia la detección de productos de calidad subestándar y todo incidente relacionado con efectos adversos o con la ausencia de los efectos previstos.
También ha aconsejado redoblar la vigilancia y la diligencia en las cadenas de suministro de aquellos países y regiones que puedan verse afectados por estos productos de calidad subestándar.
















